DNA 이중나선절단 복구’에 ‘틀린짝 복구’ 핵심 단백질 관여로 돌연변이 적게 생기도록 복구
암세포 손상 복구 억제하는 항암제 개발 등에 기여할 것으로 기대
기초과학연구원(IBS, 원장 노도영) 유전체 항상성 연구단 명경재 단장(UNIST 바이오메디컬공학과 특훈교수) 연구팀은 손상된 유전자를 복구하기 위해 서로 다른 유전자 복구 메커니즘들이 유기적으로 상호작용하고 있음을 처음으로 밝혔다. 지금까지는 한 종류의 DNA 손상 과정을 복구하기 위해 그에 한정된 하나의 복구 메커니즘만 작용하는 것으로 알려져 있었다.
DNA는 생명 유지에 필요한 정보를 가지고 있다. 그런데 방사능, 자외선 등의 여러 환경적 자극이나 화학물질 노출로 인해 DNA 일부분이 절단되어 손상되거나, 절단 부위가 다른 곳에 가 붙게 되는 등 변형이 올 수 있다. 이로 인해 DNA 정보에서 만들어지는 단백질이 제대로 만들어지지 않거나, 단백질의 기능에 이상이 생기게 된다. 그리고 이러한 DNA 손상과 변형이 세포에 쌓이게 되면 결국 노화와 암을 유발한다. 따라서 DNA 손상을 빠르게 복구하는 것은 생명 활동을 유지하는 데 무척 중요하다.
세포는 DNA가 입는 여러 형태의 손상에 대해 다양한 복구 메커니즘으로 대응하고 있다. 가장 심각한 DNA 손상인 ‘DNA 이중나선절단(DNA double strand break)’은 심한 경우 세포사멸에까지 이를 수 있다. DNA 이중나선절단에 대한 복구는 세포가 어떤 복구과정을 선택하는지에 따라 다른 양상이 나타나는데, ‘상동재조합 복구(homologous recombination repair)’ 과정을 선택하면 DNA의 유전정보가 그대로 유지되지만 ‘작은 유사 염기 이용 복구(polymerase theta-mediated end-joining)’ 과정을 선택하면 일부 유전정보가 손실되어 돌연변이를 야기한다.
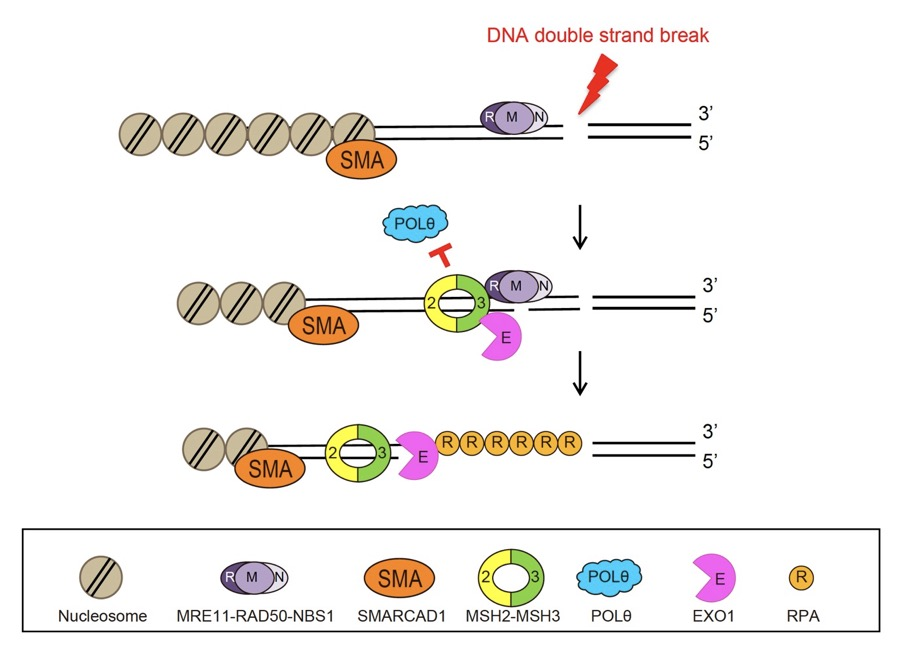
그림1. 새롭게 발견된 DNA 이중나선 절단 복구 방법따라서 DNA 유전 정보의 항상성을 유지하기 위해 어떤 DNA 이중나선절단 복구 과정을 사용하는지가 매우 중요하다. 하지만 DNA 이중나선절단 복구 과정의 선택은 어떤 단백질에 의해 이루어지고, 이 단백질이 어떻게 DNA 절단 손상을 인식하고 복구하게 되는지에 대해서는 명확히 밝혀지지 않았다.
이번 연구는 DNA 이중나선절단 복구 과정을 구체적으로 관찰하면서, 다른 독립적인 DNA 복구기전인 ‘DNA 틀린짝 복구(mismatch repair)’의 핵심 단백질인 MSH2-MSH3가 중요하게 관여한다는 것을 최초로 밝혔다.
연구진은 세포에 355 나노미터(nm) 레이저를 조사해 DNA 이중나선절단 부위를 만들고, MSH2-MSH3 단백질과 다른 복구 관련 단백질들을 형광단백질로 표지해 손상 부위로의 이동과 결합을 관찰했다. 그 결과, MSH2-MSH3 단백질이 염색체 구조를 풀어주는 단백질과의 결합을 통해 이중나선절단 부위로 이동해 손상부위에 결합하는 것을 확인했다. 그리고 손상 부위에서 DNA 이중나선 구조를 단일나선 가닥으로 절개하는 효소인 EXO1을 끌어온 뒤 EXO1을 활성화시켜 손상된 DNA 끝단의 절단을 증가시켰다. 이렇게 EXO1에 의해서 DNA 끝단의 절단이 이루어지면 상동재조합 복구가 유도되어 돌연변이가 감소된다.
또한, DNA 손상부위에 MSH2-MSH3 단백질이 결합함으로써 돌연변이가 유도될 수 있는 작은 유사 염기 이용 복구 메커니즘의 핵심인 POLQ 단백질의 접근을 막아 돌연변이를 억제하는 것을 발견했다.
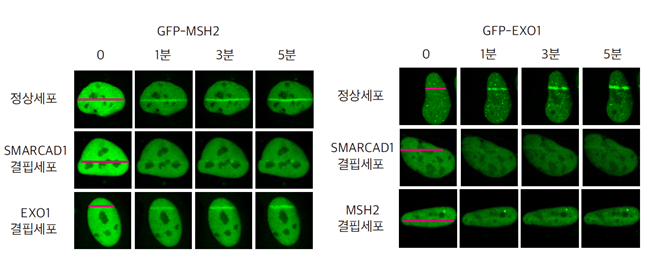
그림2. SAMRCAD1-MSH2-EXO1의 순서로 DNA 이중나선절단 부위로 접근
명경재 단장은 “이중나선절단 복구, 틀린짝 복구, 작은 유사 염기 이용 복구 등 기존에 서로 완전히 독립적으로 작용할 것이라고 여겨지던 복구 메커니즘과 관련 단백질들이 서로 유기적으로 상호작용하는 것을 처음 밝힌 성과”라며, “이번 연구성과가 손상된 DNA의 복구를 막아 암세포의 비정상적인 증식을 억제하는 항암제 개발 등에 기여할 것으로 기대한다”라고 밝혔다.
이번 연구에는 울산과학기술원(UNIST) 이자일 교수 연구팀과 부산대학교 오정민 교수 연구팀이 공동으로 참여했으며, 연구결과는 국제 학술지 핵산 연구(Nucleic Acids Research, IF 19.16)에 5월 4일 온라인 게재됐다.
(이 보도자료는 IBS 유천체항상성 연구단에서 제공하였습니다.)
자료출처: 손상된 유전자 복구 위한 여러 복구 메커니즘의 상호작용 최초 확인 | UNIST News Center